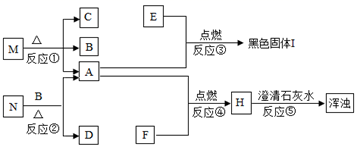
如图是一些常见物质之间的转化关系,其中A 是能使带火星木条复燃的气体;B在反应前后其质量和化学性质都不发生变化;E是生活中常见的金属单质,E在气体A中的燃烧时火星四射,生成黑色固体。
请回忆所学内容,回答下列问题:
(1)写出物质M、N的名称:M_____;N_____;
(2)写出下列物质的化学式:
A_____; B_____; H_____; I_____;
(3)构成物质的基本粒子有分子、原子、离子三种。化合物D是由_____(填“分子”、“原子”、“离子”)构成的。
(4)反应_____(填序号①~⑤)在实验室常用来验证某气体是否为二氧化碳。
(5)Fe3O4中铁元素的化合价为_____;实际上Fe3O4中铁元素呈+2、+3价,我们可以将Fe3O4写成FeO•Fe2O3;以后我们还会知道,Fe3O4也可以写成![]() ,则在
,则在![]() 中,带“▲”号的Fe的化合价为_____价。
中,带“▲”号的Fe的化合价为_____价。
答案
高锰酸钾 氯酸钾 O2。 MnO2 CO2 Fe3O4 离子 ⑤ +![]() +3
+3
【分析】
A 是能使带火星木条复燃的气体,则A是氧气,B是在反应前后其质量和化学性质都不发生变化,且在B的作用下N能分解生成氧气,故B是二氧化锰,则M是高锰酸钾,C是锰酸钾。E是金属,能与氧气在点燃的条件下反应生成黑色的固体,故E是铁,I是四氧化三铁,H能使澄清石灰水变浑浊,则H是二氧化碳。N在二氧化锰做催化剂的条件下加热分解生成氧气,故N是氯酸钾。
【详解】
(1)由以上分析可知,M是高锰酸钾,N是氯酸钾。
(2)由分析可知,A是氧气,化学式为:O2。B是二氧化锰,化学式为:MnO2。H是二氧化碳,化学式为:CO2。I是四氧化三铁,化学式为:Fe3O4。
(3)物质D是氯化钾,由钾离子和氯离子构成。
(4)反应⑤是二氧化碳与澄清石灰水反应,可以检验二氧化碳。
(5)Fe3O4中氧元素的化合价为-2价,根据化合价的代数和为0,铁元素的化合价为+![]() 。
。![]() 中,带“▲”号的Fe的化合价与Fe2O3中铁的化合价相同,故化合价为+3价。
中,带“▲”号的Fe的化合价与Fe2O3中铁的化合价相同,故化合价为+3价。