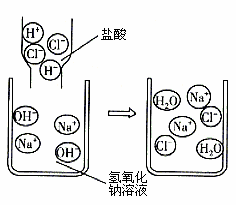
氢氧化铝是一种难溶于水的重要化学物质,医学上可用于治疗胃酸过多。
(1)写出用氢氧化铝治疗胃酸过多的化学方程式_____。人体服氯化铝溶液用氢氧化铝后胃液的pH会_____,(填“增大”或“减小”)。
(2)实验小组同学发现将氯化铝溶液逐滴加入氢氧化钠溶液中(如图1),发现刚开始并无氢氧化铝沉淀生成,为了探究刚开始没有沉淀生成的原因,同学们进行如下探究。

(查阅资料)①氢氧化铝属于两性物质,既可和酸(如盐酸)反应,又可和碱(如氢氧化钠溶液)反应。其中与NaOH反应的化学方程式为![]() 。
。
②NaAlO2(偏铝酸钠)可溶于水,可与少量酸反应生成氢氧化铝,但不与碱发生反应。
(提出猜想)
甲:可能所用的氢氧化钠溶液中含有酸,生成的沉淀与酸反应。
乙:可能生成的氢氧化铝与试管中过量的氢氧化钠反应。
(3)丙同学立刻否认了甲同学的猜想,理由是_____。
(实验验证)
为了验证乙同学的猜想,同学们设计了如下实验:
| 实验操作 | 现象 | 结论 |
| 取一定量氢氧化铝粉末,向其中逐滴加入氢氧化钠溶液至过量 | _____。 | 乙同学猜想正确 |
(思维拓展)上述实验说明反应物相同时,质量比不同会导致生成物不同,除上述化学反应外请你再举一例:_____。
(反思提高)不用其他试剂如何区别氯化铝和氢氧化钠两种无色澄清溶液_____。
该兴趣小组同学将氢氧化钠溶液逐滴加入到氯化铝溶液中,测得反应过程中生成沉淀质量变化如图2:

(4)分别写出a点、c点所对应溶液中溶质的成分_____(写化学式,下同),_____。向a点所得溶液中逐滴加入稀盐酸至过量,实验时的现象是_____。
(5)当b点所滴人的氢氧化钠溶液质量为mg时,则a点时所滴入溶液质量为_____。
答案
(1)![]() 增大
增大
(3)氢氧化钠会与酸发生反应,故氢氧化钠溶液中一定不含有酸
(实验验证) 固体逐渐溶解,最终完全消失
(思维拓展)木炭燃烧,氧气充足时生成二氧化碳,氧气不足时生成一氧化碳(合理即可)
(反思提高) 取其中A试剂滴加到B试剂中,如果一开始就出现沉淀,则A为氢氧化钠溶液,若开始时无明显现象,则A试剂是氯化铝溶液
(4) NaAlO2和NaCl NaAlO2、NaCl和NaOH 有白色沉淀生成,后沉淀逐渐消失
(5)![]()
【解析】(1)氢氧化铝可以与胃液中的盐酸反应生成氯化铝和水,反应的化学方程式为:![]() ,从而中和胃液的酸性,胃液的pH增大。(提出猜想)(3)氢氧化钠会与酸发生反应,故氢氧化钠溶液中一定不含有酸,甲同学猜想错误。(实验验证)若要验证氢氧化铝是否与氢氧化钠发生反应,则可取少量的氢氧化铝于试管中,加入过量的氢氧化钠溶液,根据乙同学猜想正确,可知实验现象为氢氧化铝固体逐渐溶解,最终完全消失。(思维拓展)反应物相同时,质量比不同会导致生成物不同,根据学习过的知识举出例子,如木炭与氧气的反应。(反思提高)将氢氧化钠溶液滴人氯化铝溶液中时,开始时氢氧化钠未过量,立即有白色沉淀生成;将氯化铝溶液滴人氢氧化钠溶液中时,开始时氢氧化钠过量,没有沉淀产生,可据此设计实验方案。(4)将氢氧化钠溶液逐滴加入氯化铝溶液中,开始时氢氧化钠和氯化铝反应会生成氯化钠和氢氧化铝沉淀,当氯化铝完全转化为氢氧化铝沉淀时,继续滴入氢氧化钠,又会和氢氧化铝沉淀反应生成可溶于水的NaAlO2,所以a点溶液中的溶质成分是NaAlO2和NaCl,若继续滴加氢氧化钠,此时溶液中溶质为NaAlO2、NaCl和NaOH。向a点溶液中滴入稀盐酸,NaAlO2会与稀盐酸反应生成氢氧化铝沉淀, NaAlO2完全反应后,稀盐酸与氢氧化铝反应,沉淀又逐渐消失。(5)0到b点处发生反应
,从而中和胃液的酸性,胃液的pH增大。(提出猜想)(3)氢氧化钠会与酸发生反应,故氢氧化钠溶液中一定不含有酸,甲同学猜想错误。(实验验证)若要验证氢氧化铝是否与氢氧化钠发生反应,则可取少量的氢氧化铝于试管中,加入过量的氢氧化钠溶液,根据乙同学猜想正确,可知实验现象为氢氧化铝固体逐渐溶解,最终完全消失。(思维拓展)反应物相同时,质量比不同会导致生成物不同,根据学习过的知识举出例子,如木炭与氧气的反应。(反思提高)将氢氧化钠溶液滴人氯化铝溶液中时,开始时氢氧化钠未过量,立即有白色沉淀生成;将氯化铝溶液滴人氢氧化钠溶液中时,开始时氢氧化钠过量,没有沉淀产生,可据此设计实验方案。(4)将氢氧化钠溶液逐滴加入氯化铝溶液中,开始时氢氧化钠和氯化铝反应会生成氯化钠和氢氧化铝沉淀,当氯化铝完全转化为氢氧化铝沉淀时,继续滴入氢氧化钠,又会和氢氧化铝沉淀反应生成可溶于水的NaAlO2,所以a点溶液中的溶质成分是NaAlO2和NaCl,若继续滴加氢氧化钠,此时溶液中溶质为NaAlO2、NaCl和NaOH。向a点溶液中滴入稀盐酸,NaAlO2会与稀盐酸反应生成氢氧化铝沉淀, NaAlO2完全反应后,稀盐酸与氢氧化铝反应,沉淀又逐渐消失。(5)0到b点处发生反应![]() ,加入NaOH与生成
,加入NaOH与生成![]() 的化学计量数之比为3:1,b到a点发生反应的化学方程式为
的化学计量数之比为3:1,b到a点发生反应的化学方程式为![]() ,反应中Al(OH)3与NaOH反应的化学计量数比为1:1, 则两段反应中消耗氢氧化钠的质量之比为3:1,则a点消耗氢氧化钠的质量为
,反应中Al(OH)3与NaOH反应的化学计量数比为1:1, 则两段反应中消耗氢氧化钠的质量之比为3:1,则a点消耗氢氧化钠的质量为![]() 。
。

 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑