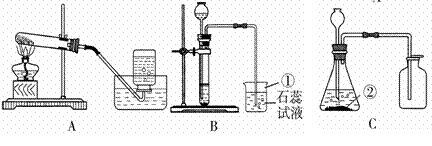
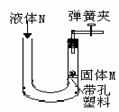
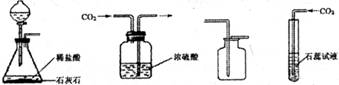
同学们利用如图所示装置进行气体的制备实验(A~F为装置编号)


(1)写出图D装置中甲仪器的名称 .
(2)用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式为 ,其中二氧化锰起 作用.
(3)实验室制取二氧化碳通常选择下列药品中的 (填药品序号).
A、稀盐酸 B.熟石灰 C.块状石灰石 D.稀硫酸
(4)常温下,可用固体硫化亚铁(FeS)和稀硫酸反应制取硫化氢(H2S)气体,若要控制滴加液体的速率,可选择的发生装置是 (填装置编号,下同).实验室制取氢气应选择的收集装置是 .
(5)制取气体前应先检查装置的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是 (填序号).
a.将烧杯换成水槽 b.导管深入水中位置过深,气体无法逸出
c.将水换成冰水 d.先用手捂住试管壁,再将导管另一端插入水中.
(5)为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品和足量稀盐酸在烧杯中反应(假设石灰石样品中的杂质不与稀盐酸反应,也不溶于水).有关实验数据如表
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150g | 12g | 157.6g | |
求该石灰石中碳酸钙的质量分数.
答案
【考点】常用气体的发生装置和收集装置与选取方法;检查装置的气密性;催化剂的特点与催化作用;二氧化碳的实验室制法;书写化学方程式、;根据化学反应方程式的计算.
【分析】(1)根据实验室常用仪器解答;
(2)根据反应物的状态和反应条件确定实验室制取氧气的发生装置;根据氧气的密度和溶解性选择收集方法;根据二氧化锰的特点回答其作用;根据反应的原理写出反应的方程式;
(3)根据实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
(4)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置和收集装置.
(5)根据检查装置气密性的方法解答.
(6)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
【解答】解:(1)根据实验室常用仪器可知:甲是集气瓶;
(2)实验室用加热氯酸钾和二氧化锰的混合物制取装置的特征属于固固加热型的A装置,其中二氧化锰作为催化剂,起到催化作用;反应的方程式为:2KClO3 ![]()
![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)实验室制取二氧化碳气体,使用的药品是大理石或石灰石和稀盐酸.
(4)制取硫化氢时不需要加热,若要控制滴加液体的速率,可选择的发生装置是,应该用C装置作为发生装置;用锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;在实验室中用锌和稀硫酸反应制取氢气,属于固液常温型,所以应该选择B或C装置来制取氢气;氢气密度比空气小,难溶于水,所以应该选择E装置来收集氢气.
(5)制取气体前应先检查装置的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是
将烧杯换成水槽;导管深入水中位置过深,气体无法逸出;将水换成冰水 无关;
检验时应先将导管放入水中,再用手捂住试管壁,故d有关.
(6)根据质量守恒定律,二氧化碳的质量为:150g+12g﹣157.6g=4.4g;
(2)设该石灰石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
![]()
![]()
x=10g
此石灰石中碳酸钙的质量分数为:![]()
![]() ×100%≈83.3%
×100%≈83.3%
答案:
(1)集气瓶;
(2)2KClO3 ![]()
![]() 2KCl+3O2↑;催化;
2KCl+3O2↑;催化;
(3)AC;
(4)C;E;
(5)abc
(6)83.3%.