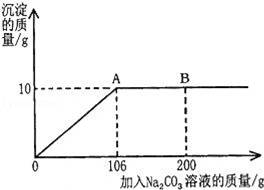
氯化钙钾石的化学式为KCl•xCaCl2(x是CaCl2的系数).它是一种天然的钾肥,溶于水后得到KCl和CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解,得到KCl和CaCl2的混合溶液.向该溶液中逐滴加入Na2CO3溶液,发生反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.请回答下列问题:
(1)图中AB段表示的意义是 .
(2)①样品中CaCl2的质量是多少?
②所用Na2CO3溶液中溶质的质量分数是多少?
(3)①样品中钾元素的质量分数是多少?(精确到0.1%)
②氯化钙钾石化学式中的x值是多少?
【要求:(2)、(3)两问写出计算过程】

答案
【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【分析】(1)图中AB段沉淀质量不变,说明溶液中的氯化钙已完全反应,加入的碳酸钠溶液过量,不再发生反应;
(2)根据碳酸钠与氯化钙生成的碳酸钙沉淀,计算出参加反应的氯化钙的质量和消耗的碳酸钠的质量;利用恰好完全反应时所加入的106g碳酸钠溶液中的碳酸钠质量与溶液质量比计算所用溶液的溶质质量分数;
(3)样品质量与氯化钙质量差即氯化钾的质量;氯化钾中钾元素质量与样品质量比可计算样品中钾元素的质量分数;根据元素质量守恒解答.
【解答】解:(1)AB段沉淀碳酸钙的质量没有改变,表示溶液中氯化钙已完全反应,继续加入的碳酸钠溶液过量;
故答案为:CaCl2已完全反应,且Na2CO3溶液过量;
(2)设恰好完全反应生成10g碳酸钙沉淀时消耗氯化钙的质量为x,消耗的碳酸钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
y x 10g
![]()
![]()
x=11.1g
y=10.6g
所用Na2CO3溶液中溶质的质量分数是![]()
![]() 100%=10%
100%=10%
(3)①样品中氯化钾的质量=18.55g﹣11.1g=7.45g
钾元素的质量为:7.45g×![]()
![]() 100%=3.9g
100%=3.9g
样品中钾元素的质量分数是![]()
![]() 100%=21.0%
100%=21.0%
②KCl•xCaCl2﹣﹣﹣﹣K
74.5+111x 39
18.55g 3.9g
![]()
![]()
x=1
答案:
(1)CaCl2已完全反应,且Na2CO3溶液过量;
(2)①样品中CaCl2的质量是11.1g;②所用Na2CO3溶液中溶质的质量分数是10%;
(3)①样品中钾元素的质量分数是21.0%;②氯化钙钾石化学式中的x值是1.
