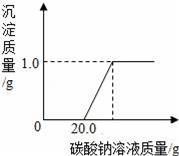
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)
求:(1)当废液中盐酸完全反应时,生成的二氧化碳的质量.
(2)实验过程中实际参加反应的碳酸钠溶液的质量为多少?
(3)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.

【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【专题】压轴实验题;溶液的组成及溶质质量分数的计算;有关化学方程式的计算.
【分析】(1)产生沉淀前消耗20.0g碳酸钠溶液,这是与废液中盐酸反应的碳酸钠溶液的质量,由于盐酸反应的碳酸钠溶液的质量和质量分数,根据二者反应的化学方程式可以计算出生成氯化钠和二氧化碳的质量.
(2)由沉淀质量碳酸钠溶液的质量分数,根据碳酸钠与氯化钙反应的化学方程式可以计算出与氯化钙反应的碳酸钠溶液的质量
和生成氯化钠的质量.两部分碳酸钠溶液合起来就是实际参加反应的碳酸钠溶液的质量.
(3)由两种反应生成的氯化钠的质量和除以所得溶液的质量就得到所得溶液中氯化钠的质量分数.
【解答】解:(1)设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
20.0g×5.3% x y
![]()
![]() =
=![]()
![]() =
=![]()
![]()
x=1.17g,y=0.44g
(2)设与氯化钙反应时,需要碳酸钠溶液的质量为z,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
z•5.3% 1g w
![]()
![]() =
=![]()
![]() =
=![]()
![]()
z=20.0g,w=1.17g
实际参加反应的碳酸钠溶液的质量为
20.0g+20.0g=40.0g
(3)所得溶液中氯化钠的质量分数为
![]()
![]() ×100%≈4.0%
×100%≈4.0%
答:(1)生成二氧化碳0.44g.
(2)实际参加反应的碳酸钠溶液的质量为40.0g.
(3)所得溶液中氯化钠的质量分数为4.0%.
【点评】本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
将一些氧化铜粉末加入到100克质量分数为14%的硫酸溶液中,微热至氧化铜全部溶解,再向蓝色溶液中加入W克铁粉,充分反应后,过滤,烘干,得到干燥的固体物质仍是Wg,求:
(1)原先氧化铜的质量是多少?
(2)最后得到的溶液中溶质的质量分数为多少?
(3)当W为何值时才能满足加入的铁粉和得到的固体质量相等?
【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)要使加入的铁粉和得到的固体质量相等必须使硫酸消耗多余的Fe:从CuSO4+Fe=FeSO4+Cu,可以看出铁转化出铜,这是一个使固体质量增加的过程,而题目明确的说明过滤后的固体质量与投入的铁粉质量相同,这只能说明氧化铜被溶解后,硫酸仍然有剩余,剩余的硫酸继续消耗铁粉,且消耗铁粉的质量与前一步固体增加的质量相等;利用这一等量关系,计算所加入氧化铜的质量;
(2)最后生成的溶质是FeSO4,它是由两部分生成的.第一部分与CuSO4反应得到的FeSO4,第二部分是铁与剩余硫酸生成的FeSO4,反应后溶液中总共含有FeSO4为两部分的质量和;根据质量守恒定律,反应后所得溶液总质量=100g稀硫酸+氧化铜的质量+铁的质量﹣析出的铜的质量(与铁的质量相等)﹣氢气质量,由于参加反应铁的质量与析出固体的质量相等,所以,反应后所得溶液的总质量=100g稀硫酸+氧化铜的质量﹣氢气质量.则最后得到溶液的质量分数为生成FeSO4的总质量与反应后所得溶液总质量的比.
(3)因为铁与硫酸铜反应生成铜,固体质量增加,根据加入Wg铁粉,与硫酸铜反应后得到固体物质为Wg可知,铁粉没有完全反应,剩余的铁粉与稀硫酸反应,最后得到的Wg固体物质为铜的质量,根据Wg铜完全来自氧化铜,故可以计算出W的值.
【解答】解:(1)设原先氧化铜的质量为m,则与氧化铜反应的硫酸的质量x,生成硫酸铜的质量y
CuO+H2SO4═CuSO4+H2O
80 98 160
m x y
![]()
![]() ,则x=
,则x=![]()
![]()
![]()
![]() ,则y=2m
,则y=2m
设加入铁粉与硫酸铜溶液充分反应固体增加的质量为a,生成硫酸亚铁的质量为c;与剩余稀硫酸反应的铁的质量为b,生成硫酸亚铁的质量为d.
Fe+CuSO4═FeSO4+Cu 固体质量增加
56 160 64 64﹣56=8
2m a
![]()
![]() ,则a=0.1m
,则a=0.1m
Fe+H2SO4═FeSO4+H2↑
56 98
b 100g×14%﹣![]()
![]()
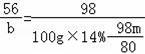
 ,b=8﹣0.7m
,b=8﹣0.7m
反应前后固体质量不变,即与硫酸反应消耗铁的质量等于与硫酸铜反应固体增加的质量,
即:a=0.1m,b=8﹣0.7m,因为a=b,解得m=10g,
答:原先氧化铜的质量为10g;
(2)方法一:
设加入铁粉与硫酸铜溶液充分反应固体增加的质量1g时生成硫酸亚铁的质量为c;与剩余稀硫酸反应的1g铁生成硫酸亚铁的质量为d,同时放出氢气质量为w
Fe+CuSO4═FeSO4+Cu 固体质量增加
56 160 152 64 64﹣56=8
c 1g
![]()
![]() ,解得c=19g
,解得c=19g
Fe+H2SO4═FeSO4+H2↑
56 152 2
1g d w
![]()
![]() ,解得d≈2.7g
,解得d≈2.7g
![]()
![]() w≈0.04g
w≈0.04g
最后得到溶液的质量分数=![]()
![]() ×100%≈19.73%
×100%≈19.73%
答:最后得到溶液的质量分数为19.73%.
方法二:由题意可知,硫酸最终全部转化为硫酸亚铁,设硫酸亚铁的质量为z:
H2SO4~FeSO4
98 152
100g×14% z
则![]()
![]() ,解得Z=
,解得Z=![]()
![]() g≈21.7g,加入铁粉的质量W=
g≈21.7g,加入铁粉的质量W=![]()
![]() ×100%=8g;
×100%=8g;
最后得到溶液的质量分数=![]()
![]() ×100%≈19.73%
×100%≈19.73%
(3)Wg铜完全来自氧化铜,根据质量守恒定律的元素守恒,则W=![]()
![]() ×100%×10g=8g
×100%×10g=8g
当W取值为等于或大于8g时,才能满足加入铁粉和得到固体质量相等的要求.
故答案为:
(1)10g;(2)19.73%;(3)8g.
【点评】分析固体质量不变的原因是解决本题的关键:要使加入的铁粉和得到的固体质量相等必须使硫酸消耗多余的Fe,且消耗铁粉的质量与置换出铜固体增加的质量相等.
20℃时硫酸的密度和溶质质量分数对照表:
| 密度(克/厘米3) | 1.07 | 1.14 | 1.30 | 1.50 | 1.73 | 1.84 |
| 溶质质量分数(%) | 10 | 20 | 40 | 60 | 80 | 98 |
为测定铜锌合金的组成,取试样5克,加入质量分数为10%的稀硫酸至恰好不再产生气体为止,收集到0.04克氢气.试计算:
(1)铜锌合金中锌的质量分数是多少?
(2)测定时用去10%的稀硫酸多少毫升?
(3)要配制上述质量分数的稀硫酸500毫升,需98%的浓硫酸多少毫升?
【考点】根据化学反应方程式的计算;用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】综合计算(图像型、表格型、情景型计算题).
【分析】锌和稀硫酸反应生成硫酸锌和氢气,根据氢气的质量可以计算锌的质量,进一步可以计算锌的质量分数;
溶液稀释前后,溶质质量分数不变.
【解答】解:(1)设锌的质量为x,反应的硫酸质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 98 2
x y 0.04g
![]()
![]() =
=![]()
![]() =
=![]()
![]() ,
,
x=1.3g,y=1.96g,
铜锌合金中锌的质量分数为:![]()
![]() ×100%=26%,
×100%=26%,
答:铜锌合金中锌的质量分数为26%.
(2)测定时用去10%的稀硫酸的体积为:1.96g÷10%÷1.07g/mL=18.3mL,
答:测定时用去10%的稀硫酸的体积为18.3mL.
(3)设需要浓硫酸的体积为z,
根据题意有:1.07g/mL×500mL×10%=1.84g/mL×z×98%,
z=29.7mL,
答:要配制上述质量分数的稀硫酸500毫升,需98%的浓硫酸29.7mL.
【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.
某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)有关实验数据如下表:
| 反应前 | 反应后 | ||
| 实 验 数 据 | 烧杯和稀盐酸 的质量 | 石灰石样品 的质量 | 烧杯和其中混 合物的质量 |
| 150g | 12g | 157.6g | |
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为 g.
(2)求该石灰石中碳酸钙的质量分数.
【考点】根据化学反应方程式的计算;质量守恒定律及其应用.
【专题】压轴实验题;有关化学方程式的计算.
【分析】(1)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;
(2)根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
【解答】解:(1)根据质量守恒定律,二氧化碳的质量为:150g+12g﹣157.6g=4.4g.
(2)设该石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
![]()
![]() ,x=10g
,x=10g
此石灰石中碳酸钙的质量分数为:![]()
![]() ×100%≈83.3%
×100%≈83.3%
答:该石灰石中碳酸钙的质量分数为83.3%.
【点评】本题主要考查有关化学方程式的计算和质量分数的计算,难度较小.
将氯酸钾与二氧化锰的混合粉末28.5克加热到不再放出氧气为止,得到固体残留物18.9克,试计算:
(1)生成氧气多少克?
(2)残留固体中都含有什么?各多少克?
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【分析】反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算氯化钾的质量,进一步可以计算二氧化锰的质量.
【解答】解:
(1)生成氧气的质量为:28.5g﹣18.9g=9.6g,
(2)设氯酸钾的质量为x,
2KClO3![]()
![]() 2KCl+3O2↑,
2KCl+3O2↑,
149 96
x 9.6g
![]()
![]()
x=14.9g
二氧化锰的质量为:18.9g﹣14.9g=4g
答案:
(1)生成氧气9.6克
(2)残余固体是KCl质量14.9克,MnO2质量4克.
【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.
本卷还有22题,登录并加入会员即可免费使用哦~

该作品由: 用户纯真女孩分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。